Concentração Dos Reagentes Exemplos Do Dia A Dia – Entenda o conceito de concentração de reagentes e sua importância em nosso dia a dia, desde a preparação de medicamentos até a garantia da qualidade dos produtos que consumimos. Vamos mergulhar no fascinante mundo da concentração e seus exemplos práticos.
Concentração de solutos em soluções

A concentração de uma solução é uma medida da quantidade de soluto presente em uma determinada quantidade de solvente ou solução. É geralmente expressa em termos de molaridade (mol/L), que representa o número de moles de soluto por litro de solução.Existem
várias unidades de medida para concentração, incluindo:* Molaridade (M): moles de soluto por litro de solução
Molalidade (m)
moles de soluto por quilograma de solvente
Normalidade (N)
equivalentes de soluto por litro de solução
Fração molar (X)
razão entre o número de moles de soluto e o número total de moles na solução
Porcentagem em massa (% m/m)
massa de soluto por 100 gramas de solução
Porcentagem em volume (% v/v)
volume de soluto por 100 mililitros de soluçãoA concentração das soluções é importante em muitos aspectos da vida cotidiana, incluindo:* Preparação de alimentos: a concentração de sal na água afeta o sabor dos alimentos
Limpeza
a concentração de produtos químicos em produtos de limpeza determina sua eficácia
Medicina
a concentração de medicamentos afeta sua potência e dosagem
Indústria
a concentração de reagentes químicos afeta a velocidade e o rendimento das reações químicasSegue uma tabela com as concentrações de algumas soluções comuns usadas em laboratórios e indústrias:| Solução | Concentração ||—|—|| Ácido clorídrico | 1 M || Hidróxido de sódio | 0,1 M || Sulfato de cobre | 0,01 M || Nitrato de prata | 0,001 M || Ácido acético | 0,0001 M |
Métodos para determinar a concentração

Existem vários métodos para determinar a concentração de uma solução, incluindo métodos titrimétricos e espectrofotométricos. Cada método tem suas vantagens e desvantagens, e a escolha do método mais adequado depende dos requisitos específicos da análise.
Métodos Titrimétricos
Os métodos titrimétricos envolvem a adição gradual de um reagente conhecido (titulador) a uma amostra desconhecida até que ocorra uma reação química completa. O ponto final da titulação é o ponto em que a quantidade equivalente de reagente foi adicionada, e pode ser determinado usando um indicador ou um eletrodo.
Vantagens dos métodos titrimétricos:
- Alta precisão e exatidão
- Relativamente simples e de baixo custo
- Pode ser usado para analisar uma ampla gama de analitos
Desvantagens dos métodos titrimétricos:
- Pode ser demorado
- Requer reagentes e equipamentos especializados
- Pode não ser adequado para soluções muito diluídas ou concentradas
Exemplos de experimentos que utilizam métodos titrimétricos:
- Titulação ácido-base para determinar a concentração de um ácido ou base
- Titulação redox para determinar a concentração de um agente oxidante ou redutor
- Titulação de precipitação para determinar a concentração de um íon metálico
Métodos Espectrofotométricos
Os métodos espectrofotométricos medem a absorção ou emissão de luz por uma amostra. A absorção ou emissão é proporcional à concentração do analito, e a lei de Beer-Lambert pode ser usada para calcular a concentração.
Vantagens dos métodos espectrofotométricos:
- Rápido e conveniente
- Pode ser usado para analisar soluções muito diluídas ou concentradas
- Pode ser automatizado
Desvantagens dos métodos espectrofotométricos:
- Pode ser menos preciso e exato do que os métodos titrimétricos
- Requer equipamentos caros
- Pode ser afetado por interferências
Exemplos de experimentos que utilizam métodos espectrofotométricos:
- Espectrofotometria UV-Vis para determinar a concentração de compostos orgânicos
- Espectrofotometria de emissão atômica para determinar a concentração de metais
- Espectrofotometria de absorção atômica para determinar a concentração de elementos
Fatores que afetam a concentração
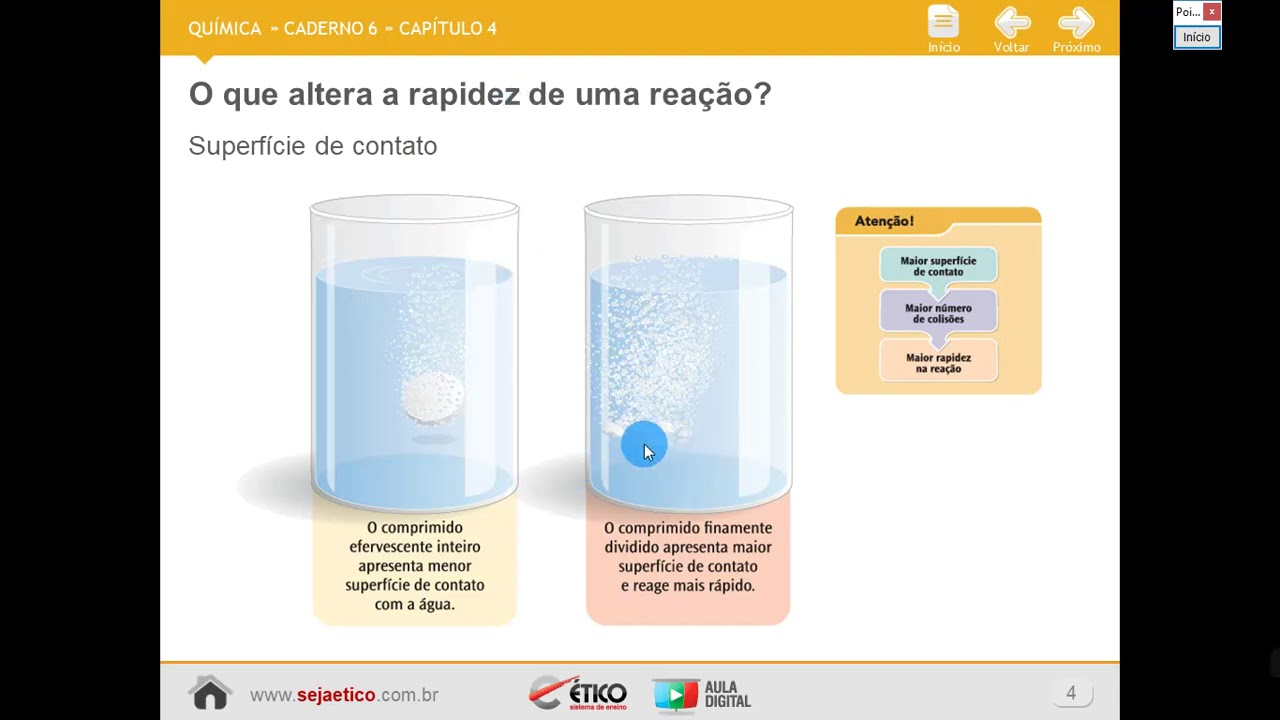
A concentração de uma solução pode ser afetada por vários fatores, incluindo temperatura, pressão e a presença de outras substâncias.
Temperatura
A temperatura afeta a concentração de uma solução porque altera a solubilidade do soluto no solvente. Em geral, a solubilidade de um soluto aumenta com a temperatura. Isso ocorre porque o aumento da temperatura fornece mais energia cinética às moléculas, o que lhes permite superar as forças intermoleculares que as mantêm juntas.
Por exemplo, se você dissolver uma determinada quantidade de sal em água fria e depois aquecer a solução, você notará que mais sal se dissolve na água quente. Isso ocorre porque o aumento da temperatura aumenta a solubilidade do sal.
Pressão, Concentração Dos Reagentes Exemplos Do Dia A Dia
A pressão também pode afetar a concentração de uma solução. No entanto, o efeito da pressão na concentração é geralmente pequeno, exceto para gases.
Quando a pressão é aplicada a um gás, as moléculas do gás são forçadas a se aproximarem, o que aumenta a concentração do gás. Por exemplo, se você encher um balão com ar e depois aplicar pressão ao balão, você notará que o balão encolhe.
Isso ocorre porque a pressão força as moléculas de ar a se aproximarem, o que aumenta a concentração do gás no balão.
Presença de outras substâncias
A presença de outras substâncias também pode afetar a concentração de uma solução. Por exemplo, se você adicionar um soluto não volátil a uma solução, a concentração do soluto volátil diminuirá. Isso ocorre porque o soluto não volátil compete com o soluto volátil pelos sítios de solvatação no solvente.
Por exemplo, se você adicionar sal a uma solução de água e álcool, a concentração de álcool na solução diminuirá. Isso ocorre porque o sal compete com o álcool pelos sítios de solvatação na água.
Aplicações da concentração

A concentração é um conceito fundamental em química que tem diversas aplicações em vários campos, incluindo química analítica, medicina e indústria.
Controle de Processos Industriais
Na indústria, a concentração é crucial para controlar processos e garantir a qualidade dos produtos. Por exemplo, na indústria farmacêutica, a concentração precisa de ingredientes ativos em medicamentos é essencial para garantir sua eficácia e segurança.
Na indústria de alimentos e bebidas, a concentração é usada para padronizar o sabor, cor e teor nutricional dos produtos. Na indústria têxtil, a concentração de corantes e outros produtos químicos determina a qualidade e durabilidade dos tecidos.
Tabela de Concentrações Ideais
A concentração ideal varia dependendo da aplicação específica. Aqui está uma tabela com concentrações ideais para diferentes aplicações:
| Aplicação | Concentração Ideal |
|---|---|
| Preparação de medicamentos | Depende do medicamento específico |
| Soluções de limpeza | Varia dependendo do tipo de solução |
| Análise química | Depende do analito e do método analítico |
Diluição e concentração: Concentração Dos Reagentes Exemplos Do Dia A Dia

Diluição é o processo de reduzir a concentração de uma solução adicionando mais solvente. A concentração é o processo de aumentar a concentração de uma solução adicionando mais soluto.
A fórmula para calcular a nova concentração após a diluição é:
C1V 1= C 2V 2
Onde:
- C 1é a concentração inicial
- V 1é o volume inicial
- C 2é a concentração final
- V 2é o volume final
Diluição em série
A diluição em série é uma técnica usada para preparar uma série de soluções com concentrações decrescentes. Para realizar uma diluição em série, uma solução original é diluída repetidamente com solvente.
A concentração de cada solução na série de diluição é metade da concentração da solução anterior.
Guia passo a passo para preparar soluções com concentrações específicas
Para preparar uma solução com uma concentração específica, siga estas etapas:
- Determine a quantidade de soluto necessária para preparar a solução.
- Dissolva o soluto em uma pequena quantidade de solvente.
- Transfira a solução para um recipiente volumétrico e adicione solvente até a marca.
- Misture bem a solução.
A concentração de reagentes é um conceito fundamental em diversas áreas, permitindo-nos controlar processos, garantir a qualidade e entender fenômenos químicos. Ao compreender os princípios da concentração, podemos aprimorar nossa compreensão do mundo ao nosso redor e tomar decisões informadas em nossas vidas diárias.

