Ligação Metálica: Uma Exploração Detalhada: De Um Exemplo Como Ocorre Esse Tipo De Ligacao Metalica
De Um Exemplo Como Ocorre Esse Tipo De Ligacao Metalica – A ligação metálica é um tipo de ligação química que ocorre entre átomos de metais. Compreender sua natureza é fundamental para explicar as propriedades únicas dos materiais metálicos, presentes em inúmeros objetos do nosso cotidiano. Este texto detalha a estrutura, propriedades e aplicações desse tipo de ligação, fornecendo uma visão abrangente do assunto.
Introdução à Ligação Metálica
Metais possuem uma estrutura atômica caracterizada por átomos com poucos elétrons na camada de valência, fracamente ligados ao núcleo. O modelo do “mar de elétrons” descreve esses elétrons de valência como deslocalizados, formando uma nuvem eletrônica que envolve os cátions metálicos. Essa mobilidade eletrônica é a chave para entender as propriedades dos metais. Os elétrons não estão ligados a um átomo específico, mas sim compartilhados entre todos os átomos do metal, criando uma força de atração eletrostática entre os íons positivos e a nuvem de elétrons negativa.
Essa interação eletrostática é responsável pela coesão do metal.
Propriedades Resultantes da Ligação Metálica

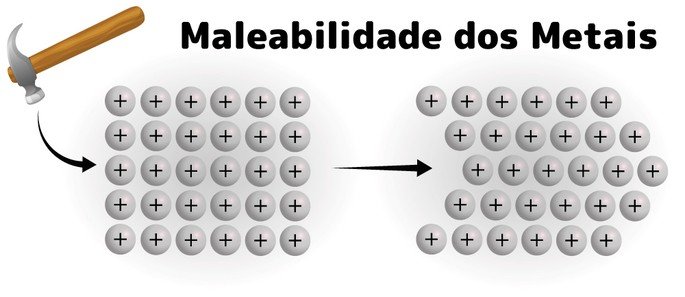
A ligação metálica confere aos metais propriedades físicas distintas. Três propriedades marcantes são a condutividade elétrica, a maleabilidade e a ductilidade.
| Propriedade | Descrição | Explicação baseada na ligação metálica | Exemplo de metal |
|---|---|---|---|
| Condutividade Elétrica | Capacidade de conduzir corrente elétrica. | A mobilidade dos elétrons no “mar de elétrons” permite o fácil transporte de carga elétrica. | Cobre (Cu) |
| Maleabilidade | Capacidade de ser deformado em lâminas finas. | Os átomos metálicos podem deslizar uns sobre os outros sem quebrar a ligação metálica, devido à deslocalização dos elétrons. | Ouro (Au) |
| Ductilidade | Capacidade de ser deformado em fios. | Similar à maleabilidade, a deslocalização eletrônica permite o rearranjo dos átomos sem perda significativa da força de ligação. | Prata (Ag) |
A condutividade elétrica dos metais é significativamente maior do que a de materiais com ligações iônicas ou covalentes, pois estes últimos possuem elétrons fortemente ligados aos átomos. A maleabilidade e ductilidade são consequências diretas da capacidade dos átomos metálicos de se moverem uns em relação aos outros sem romper a ligação metálica.
Tipos de Ligações Metálicas e suas Variações
A força da ligação metálica varia dependendo do metal puro ou da liga metálica em questão. Metais puros exibem ligações metálicas mais homogêneas, enquanto ligas metálicas, formadas por dois ou mais metais, apresentam ligações com variações na força e na estrutura. A força da ligação também é influenciada pela posição do metal na tabela periódica; metais de transição, por exemplo, geralmente apresentam ligações metálicas mais fortes devido ao maior número de elétrons de valência disponíveis para a deslocalização.
A estrutura cristalina, com seus diferentes arranjos atômicos, também influencia a força da ligação metálica, afetando propriedades como a resistência mecânica.
Exemplos de Ligações Metálicas em Materiais do Cotidiano, De Um Exemplo Como Ocorre Esse Tipo De Ligacao Metalica
Diversos objetos do nosso dia a dia são feitos de materiais com ligações metálicas, explorando suas propriedades vantajosas.
- Fios elétricos (Cobre): O cobre é amplamente utilizado devido à sua alta condutividade elétrica, permitindo a eficiente transmissão de energia elétrica.
- Latas de alumínio (Alumínio): O alumínio é leve, maleável e resistente à corrosão, tornando-o ideal para embalagens.
- Carrocerias de automóveis (Aço): O aço, uma liga de ferro e carbono, possui alta resistência mecânica e é utilizado na construção de veículos.
| Objeto | Metal e Descrição da Aplicação/Justificativa |
|---|---|
| Fios elétricos | Cobre: Alta condutividade elétrica, permitindo eficiente transmissão de energia. |
| Latas de alumínio | Alumínio: Leveza, maleabilidade, resistência à corrosão, ideal para embalagens. |
| Carrocerias de automóveis | Aço (liga de ferro e carbono): Alta resistência mecânica, essencial para segurança e estrutura do veículo. |
A ligação metálica é crucial para a funcionalidade desses objetos, fornecendo as propriedades necessárias para cada aplicação.
Influência da Ligação Metálica nas Propriedades Mecânicas
A resistência mecânica dos metais está diretamente ligada à força da ligação metálica. Ligações mais fortes resultam em materiais mais resistentes. A dureza também é afetada pela força da ligação e pela estrutura cristalina. A temperatura influencia a força da ligação metálica: o aumento da temperatura aumenta a vibração dos átomos, enfraquecendo a ligação e, consequentemente, diminuindo a resistência e a dureza do material.
Ilustração da Ligação Metálica
Imagine um modelo esquemático: cátions metálicos (íons positivos) regularmente espaçados, imersos em um “mar” de elétrons deslocalizados. Esses elétrons movem-se livremente entre os íons, criando uma força atrativa que mantém a estrutura metálica coesa. A distribuição espacial dos elétrons é uniforme, não estando associados a um átomo específico. A estrutura cristalina resulta da organização tridimensional desses cátions, com os elétrons preenchendo o espaço entre eles.
Essa estrutura é influenciada pelo tamanho e pela carga dos íons, resultando em diferentes tipos de arranjos cristalinos.
Concluindo nossa exploração da ligação metálica, percebemos a importância fundamental dessa força na construção do nosso mundo material. De objetos cotidianos a tecnologias avançadas, a ligação metálica desempenha um papel crucial, conferindo propriedades únicas e essenciais aos metais. Compreender sua natureza nos permite apreciar a engenhosidade da natureza e a capacidade humana de manipular essas propriedades para criar materiais com características específicas.
A beleza da ligação metálica reside na sua simplicidade e na sua imensa complexidade, uma demonstração eloquente da interação entre átomos e suas consequências no mundo macroscópico. A pesquisa continua, buscando novas ligas e aplicações, impulsionando o progresso tecnológico e científico.

