Gases na Atmosfera Terrestre: De Um Exemplo De Como Cada Um Dos Seguintes Gases
De Um Exemplo De Como Cada Um Dos Seguintes Gases – A atmosfera terrestre é uma mistura complexa de gases que desempenha um papel crucial na manutenção da vida no planeta. Sua composição varia com a altitude, mas a composição próxima à superfície é relativamente constante. A compreensão da composição atmosférica e dos ciclos biogeoquímicos dos gases é fundamental para entender os processos climáticos e ecológicos da Terra.
Composição da Atmosfera Terrestre

O nitrogênio (N 2) constitui aproximadamente 78% da atmosfera, seguido pelo oxigênio (O 2) com cerca de 21%. O argônio (Ar), um gás nobre, representa aproximadamente 0,93%, enquanto o dióxido de carbono (CO 2) está presente em uma proporção menor, porém crucial, atualmente em torno de 0,04%. Outros gases, como o neônio, hélio, criptônio, xenônio e o óxido nitroso (N 2O), também estão presentes em quantidades vestigiais, mas com impactos significativos em determinados processos.
Propriedades e Importância do Nitrogênio e Oxigênio
O nitrogênio, um gás inerte a temperatura ambiente, é essencial para a formação de aminoácidos e proteínas, componentes fundamentais da vida. O oxigênio, por sua vez, é vital para a respiração aeróbica, processo que libera energia para as funções vitais dos seres vivos. A diferença crucial reside na sua reatividade: o oxigênio é altamente reativo, enquanto o nitrogênio é relativamente inerte, necessitando de condições específicas para reagir.
Essa diferença de reatividade determina seus papéis distintos nos processos biológicos.
Ciclos Biogeoquímicos do Carbono e Nitrogênio
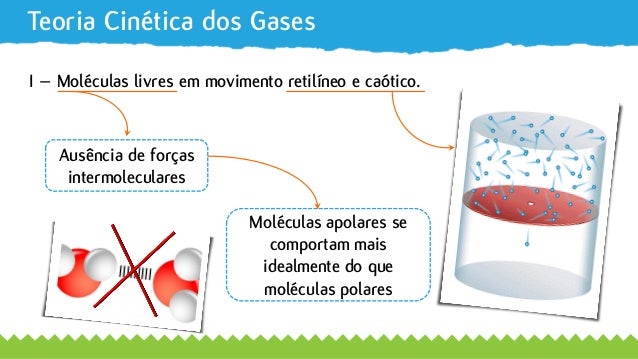
O ciclo do carbono envolve a troca contínua de carbono entre a atmosfera, a biosfera, a hidrosfera e a geosfera. O dióxido de carbono atmosférico é absorvido pelas plantas durante a fotossíntese, e liberado na respiração dos seres vivos e na combustão de matéria orgânica. O ciclo do nitrogênio é mais complexo, envolvendo processos como fixação de nitrogênio atmosférico por bactérias, nitrificação, assimilação pelas plantas e animais, e desnitrificação, que retorna o nitrogênio à atmosfera na forma de óxido nitroso e nitrogênio gasoso.
Um diagrama ilustraria visualmente a complexa interação entre esses ciclos, mostrando os fluxos de carbono e nitrogênio entre os diferentes reservatórios. A interconexão entre esses ciclos é evidente, com o dióxido de carbono influenciando a acidificação dos oceanos, afetando a disponibilidade de nutrientes para a vida marinha, e o óxido nitroso contribuindo para o efeito estufa.
| Gás | Fontes | Impactos Ambientais | Soluções para Redução de Emissão |
|---|---|---|---|
| Dióxido de Carbono (CO2) | Combustíveis fósseis, desmatamento, indústria | Aquecimento global, acidificação dos oceanos | Energias renováveis, reflorestamento, eficiência energética |
| Metano (CH4) | Agricultura, pecuária, vazamentos de gás natural | Potente gás de efeito estufa | Melhores práticas agrícolas, captura de metano |
| Óxido Nitroso (N2O) | Agricultura, indústria, combustão de combustíveis fósseis | Gás de efeito estufa e destruição da camada de ozônio | Fertilizantes mais eficientes, tecnologias de controle de emissões |
| Ozônio (O3) troposférico | Reações fotoquímicas entre óxidos de nitrogênio e compostos orgânicos voláteis | Problemas respiratórios, danos à vegetação | Controle de emissões de poluentes atmosféricos |
Gases em Processos Industriais
Diversos gases são empregados em processos industriais, cada um com suas propriedades específicas e riscos associados. A manipulação segura desses gases é crucial para prevenir acidentes e proteger a saúde dos trabalhadores e o meio ambiente.
Principais Gases Industriais e suas Aplicações
O cloro (Cl 2) é usado no tratamento de água e na produção de diversos produtos químicos. O metano (CH 4) e o propano (C 3H 8) são amplamente utilizados como combustíveis e refrigerantes. O gás hidrogênio (H 2) é fundamental em diversos processos químicos, incluindo a produção de amônia (NH 3) através do processo Haber-Bosch. A soldagem a arco utiliza gases protetores, como o argônio, para evitar a oxidação do metal.
Riscos e Medidas de Segurança na Manipulação de Gases Industriais
Gases como o cloro são altamente tóxicos e reativos, exigindo equipamentos de proteção individual (EPIs) adequados e procedimentos rigorosos de manuseio. O metano e o propano são inflamáveis e explosivos, necessitando de sistemas de ventilação adequados e armazenamento seguro. Medidas de segurança incluem a instalação de detectores de vazamento, sistemas de alarme e treinamento adequado dos trabalhadores.
Propriedades de Segurança de Gases em Indústrias Alimentícias
- Dióxido de Carbono (CO2): Utilizado como refrigerante e na carbonatação de bebidas. Requer armazenamento em recipientes resistentes à pressão e manuseio cuidadoso para evitar o congelamento.
- Nitrogênio (N2): Empregado como atmosfera modificada em embalagens de alimentos, prolongando sua vida útil. Deve ser armazenado em cilindros adequados e manuseado com precauções para evitar asfixia.
- Argônio (Ar): Utilizado em embalagens de alimentos para prevenir oxidação. O argônio é inerte e não apresenta riscos tóxicos, mas o manuseio inadequado de cilindros pressurizados pode causar acidentes.
Gases em Reações Químicas
As reações químicas frequentemente resultam na formação de gases, que podem ser identificados e quantificados através de equações químicas balanceadas. A compreensão dessas reações é fundamental em diversos campos, desde a indústria química até a ciência ambiental.
Formação de Gases em Reações Químicas
A combustão completa de hidrocarbonetos produz dióxido de carbono e água:
CxH y + (x + y/4)O 2 → xCO 2 + (y/2)H 2O
. A decomposição térmica do carbonato de cálcio produz óxido de cálcio e dióxido de carbono:
CaCO3 → CaO + CO 2
. A síntese de amônia a partir de nitrogênio e hidrogênio é um exemplo de reação que produz um gás:
N2 + 3H 2 → 2NH 3
.
Comparação entre as Reações que Produzem Dióxido de Carbono e Monóxido de Carbono
A combustão completa produz dióxido de carbono (CO 2), enquanto a combustão incompleta produz monóxido de carbono (CO), um gás altamente tóxico. A diferença reside na quantidade de oxigênio disponível durante a reação. O CO 2 é um gás de efeito estufa, enquanto o CO é um poluente atmosférico perigoso.
Produção de Gás Hidrogênio por Eletrólise da Água
A eletrólise da água utiliza uma corrente elétrica para decompor a água (H 2O) em seus componentes, hidrogênio (H 2) e oxigênio (O 2). O processo requer um eletrólito, como ácido sulfúrico diluído, e eletrodos inertes, como platina. A reação é:
2H2O → 2H 2 + O 2
. O hidrogênio produzido pode ser coletado e utilizado como combustível ou em outras aplicações industriais.
Gases e o Efeito Estufa
O efeito estufa é um processo natural que mantém a temperatura da Terra em níveis habitáveis. No entanto, o aumento das concentrações de gases de efeito estufa na atmosfera devido às atividades humanas tem intensificado esse efeito, levando ao aquecimento global.
Mecanismo do Efeito Estufa e Gases Responsáveis, De Um Exemplo De Como Cada Um Dos Seguintes Gases
Os gases de efeito estufa absorvem a radiação infravermelha emitida pela superfície terrestre, impedindo que ela escape para o espaço. Os principais gases responsáveis são o dióxido de carbono (CO 2), metano (CH 4), óxido nitroso (N 2O) e gases fluorados. O aumento das concentrações desses gases na atmosfera retém mais calor, elevando a temperatura média do planeta.
Potencial de Aquecimento Global de Diferentes Gases
O potencial de aquecimento global (PAG) é uma medida que compara a capacidade de um gás de efeito estufa de reter calor em relação ao dióxido de carbono. O metano, por exemplo, tem um PAG muito maior que o CO 2, embora sua concentração na atmosfera seja menor.
| Gás de Efeito Estufa | Fontes Antropogênicas | Contribuição para o Aquecimento Global |
|---|---|---|
| Dióxido de Carbono (CO2) | Combustíveis fósseis, desmatamento, indústria | Maior contribuinte para o aquecimento global |
| Metano (CH4) | Agricultura, pecuária, vazamentos de gás natural | Potente gás de efeito estufa com alto PAG |
| Óxido Nitroso (N2O) | Agricultura, indústria, combustão de combustíveis fósseis | Contribui significativamente para o aquecimento global e destruição da camada de ozônio |
| Gases Fluorados | Indústria, refrigeração | Alto PAG, contribuem significativamente para o aquecimento global |
Gases Nobres e suas Aplicações
Os gases nobres, também conhecidos como gases inertes, são um grupo de elementos químicos que apresentam baixa reatividade devido à sua configuração eletrônica estável. Essa propriedade os torna úteis em diversas aplicações.
Propriedades dos Gases Nobres
Os gases nobres (hélio, neônio, argônio, criptônio, xenônio e radônio) são caracterizados por sua inércia química, ou seja, sua baixa tendência a formar compostos químicos. Suas propriedades físicas variam de acordo com sua massa atômica, influenciando suas aplicações.
Aplicações dos Gases Nobres
O hélio é utilizado em balões, devido à sua baixa densidade. O neônio é empregado em lâmpadas de néon, devido à sua luminescência. O argônio é usado como gás de proteção em soldagem e em lâmpadas incandescentes. O criptônio, xenônio e radônio têm aplicações mais especializadas, como em lasers e medicina.
Uso do Hélio em Balões e Alternativas Sustentáveis
A escassez de hélio, um recurso não renovável, tem levado à busca por alternativas sustentáveis para o enchimento de balões, como o uso de hidrogênio ou gás natural. No entanto, é crucial considerar as questões de segurança associadas ao uso do hidrogênio, que é inflamável.
Ao concluir nossa jornada pelo fascinante mundo dos gases, fica evidente a intrincada relação entre esses compostos invisíveis e a vida na Terra. De sua importância vital na respiração e fotossíntese aos perigos associados à sua manipulação industrial e ao seu impacto no clima global, compreender as propriedades e comportamentos dos gases é crucial para a tomada de decisões informadas e responsáveis.
A busca por soluções sustentáveis, a inovação em tecnologias limpas e a conscientização da população são passos essenciais para mitigar os impactos negativos e garantir a preservação do equilíbrio ambiental para as gerações futuras. A pesquisa contínua e a colaboração global são fundamentais para navegarmos com segurança por esse complexo e dinâmico cenário.

